MAH试点之路任重而道远
2018年10月27日,中央人民政府网发布了将MAH(药品上市许可持有人)制度试点工作延长一年的决定,以便更好地总结药品上市许可持有人制度试点工作经验,为改革完善药品管理制度打好基础,并做好药品上市许可持有人制度试点工作和《中华人民共和国药品管理法》修改的衔接工作。
MAH试点工作的延期,说明了国家药监局对这段时间试点工作所取得成效的认同,但同时也存在着一些问题和漏洞需要解决,尤其是在这样一个医药政策大变革的关键时期,对一项还不太成熟的新政策保持一个谨慎认真的态度也是十分有必要的。
01
政策归纳
2016年11月5日,MAH试点工作在北京、天津、河北、上海、江苏、浙江、福建、山东、广东、四川十省市开展,试点对象包括(1)本方案实施后批准上市的新药,包括化学药品原注册分类1-4类、第5类(仅限靶向制剂、缓释制剂和控释制剂)和新注册分类1-2类,中药及天然药品第1-6类,治疗用生物制品第1、7类和生物类似药;(2)按与原研药品质量和疗效一致的新标准或通过一致性评价后批准上市的仿制药;(3)本方案实施前已批准上市的部分药品,可适用于药品生产企业整体搬迁或被兼并后整体搬迁,但不包括麻醉药品、精神药品、医疗用毒性药品、放射性药品、预防用生物制品和血液制品,另外不管是MAH的持有人还是委托生产的单位都不能超出这十个省市的试点范畴,政策从设立之初就有一定的地域和品种局限性,因此该项政策在试点地区的推行免不了地方政策的大力支持。
表1 试点地区MAH政策盘点:
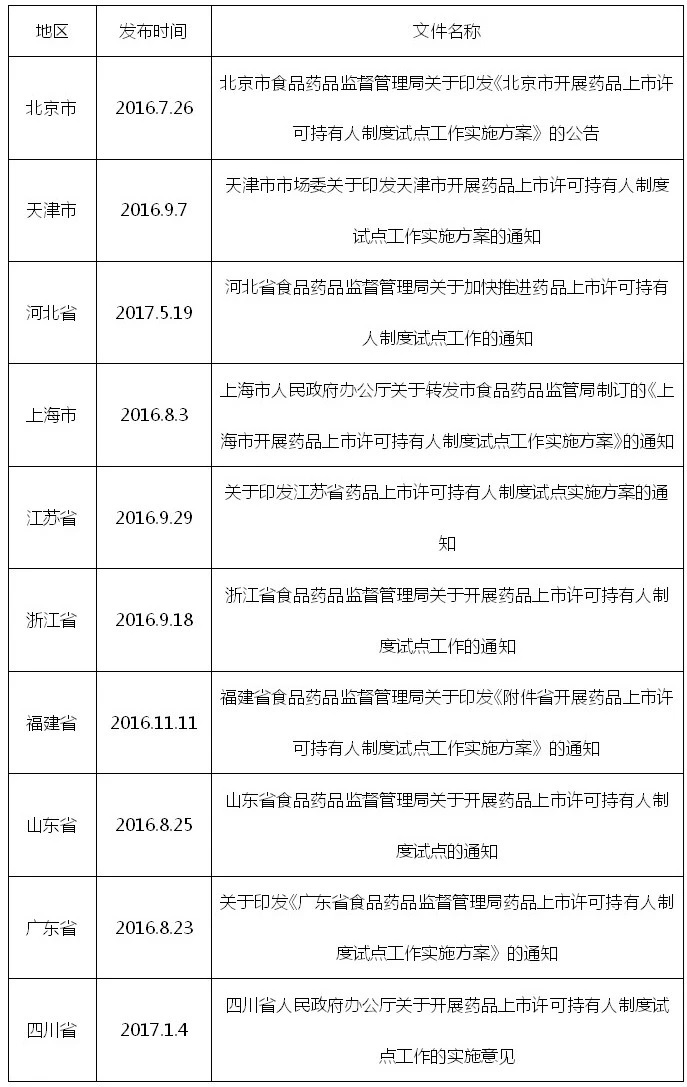
可以看出,在国家政策发布后,试点各省份也相继做出响应,并为MAH政策试点的推行制定了一系列的优惠鼓励政策,包括现金奖励、优先受理审评,推动研发机构和生产企业联动等,为MAH试点工作的顺利进行保驾护航。
02
成果一览
从目前国家药监局和各地省药监局公布的新闻和数据来看,MAH试点工作完成了多项第一的成就,其中就包括第一个获批的MAH仿制药品种:山东齐鲁制药的吉非替尼原料药及片剂(2016年12月);第一个获批的MAH创新药品种:浙江医药股份有限公司的苹果酸奈诺沙星原料药及胶囊(2017年3月);第一个通过MAH制度完成药品生产技术转移:广药集团华佗再造丸在内的75个品种转移至广州白云山奇星药业有限公司生产(2017年6月);第一个MAH试点中药品种:浙江康德药业集团有限公司的丹龙口服液(2017年9月)。
另外,通过最新上线的中国上市药品目录集可以看出,试点区域的药品大多都采用MAH制度进行申报,持有人多为企业,研发机构较少,这可能和研发机构承担药品质量安全责任承担能力不强有关,具体试点各省市的MAH试点品种申报情况国家局还未公布,不过根据去年的规律,明年1月初应该会对试点各省市的申报情况进行公布,到时候我们可以对这三年来的MAH试点成果有个更加明确清晰的了解。
03
现存问题
目前,MAH试点过程中最常见最普遍的问题就是如何落实药品上市许可人的职责,确保药品的质量监管处于可控的范围,新制度要求药品上市许可人对药品的全生命周期质量负责,对药品上市许可持有人的风险承担能力要求也愈发提高,如何统筹规划,做好药品全生命周期各个环节的质量监管工作,对持有人、生产企业还是监管部门来说都是一个不小的挑战。
在今年9月30日的时候,国家食品药品监督管理总局发布了《关于药品上市许可持有人直接报告不良反应事宜的公告》,对不良反应报告主体责任做出要求,主要有如下八条,
(1)持有人应当建立健全药品不良反应监测体系;
(2)持有人应当及时报告药品不良反应;
(3)持有人应当报告获知的所有不良反应;
(4)持有人应当加强不良反应监测数据的分析评价;
(5)持有人应当主动采取有效的风险控制措施;
(6)加强对持有人药品不良反应监测工作的技术审核;
(7)省级药品监督管理部门承担属地监管责任;
(8)严厉查处持有人不履行直接报告责任的行为。
将药品不良反应报告的主体由药企转变为药品上市许可持有人,意图是加强药品不良反应的监管,但是依然存在着药品上市许可持有人对药品不良反应监测不了解,不愿意主动上报药品不良反应情况等问题,另外从现今试点情况来看,大多数药品上市许可持有人依旧是药企,只是换了个头衔而已。国内药品不良反应的监管现状改善仅靠一纸公文还远远不够,还需要加强药品监管知识的宣传教育,建立健全奖惩机制,引入保险概念为药品上市许可持有人分担风险,加强对第三方药品不良反应委托监测机构的监管,让药品上市许可持有人了解、敢于并且能够准确的上报药品的监管信息。
MAH试点批准的品种流通性也是个问题,因为试点各省市的药品监管体系存在一定的差异,跨省市委托生产涉及的政府部门纷繁复杂,可能会出现一些“水土不服”的尴尬,因此药品上市许可持有人大部分还是选择了在本地进行委托生产,这与“加大药品流通性”的初衷是相背离的。试点各省市之间的药品研发和生产企业情况存在着很大的差异,比如上海江苏等地区的药品研发机构就相当多,相对的药品生产企业少;但山东河北等地的药品生产企业多,相对的药品研发机构少,两者之间如果可以优势互补,对药品行业的高效优质发展将产生十分重大的影响。在这一方面,江浙沪三地走在了前列,已经开始就MAH试点品种跨省委托生产的标准化管理展开了协作探索,《江浙沪药品上市许可持有人跨省委托监管规定(讨论稿)》正在商榷定稿中。
04
对医药行业影响
国家局推行MAH制度试点工作的目的是“鼓励药品研发,优化资源配置,调整产业结构,提高产业集中度,避免重复投资和建设”,对药品的研发创新和质量提升都具有重要意义。试点三年以来,也确实取得了一定的成效,将药品生产和研发分离开来,推动了医药产业的研发创新;降低了医药行业负担,提高了药品流通的灵活性,并催生了医药资源整合的新兴服务行业。
医药研发企业应该抓住这个契机,积极开发自身优势产品,摆脱单方面研发机构为药品生产企业服务的窘境,掌握药品上市的主动权,以研发带动药品的生产;药品生产企业应该按照最新的GMP要求对生产线进行改造,及时更新生产设备,确保符合药品生产的需求,能够生产出合格的产品;药品经营企业也是如此,需按照最新的GSP严格管控药品流通的全过程,仿止劣药假药流入市场;其他医疗机构和监管部门也可以积极参与其中,为药品的全生命周期安全保驾护航。
总的来说,MAH试点制度对药品领域各类资源的统一整合效果明显优于以前的药品制度,上市许可和药品生产分离也能使得两者之间的权责更加明晰,但依然还是存在着一些问题和缺陷,想要真正的推广到全国范围还需要更多一段时间的调整和适应,任重而道远。
文章来源:Particular yx 生物制品圈 1月10日